Resolução da Prova de Química UFRGS 2017

Resolução da Prova de Química UFRGS 2017
O blog Gênio da Matemática apresenta a resolução da Prova de Química UFRGS 2017 para nossos leitores!
Questão 26. (E) – Prova Comentada UFRGS 2017
Deveríamos fazer uma média percentual dos números atômicos da liga, porém nesse caso não há necessidade, pois quanto maior a Massa Molar do metal, menor o número de átomos do metal ou da liga.
Sendo as Massas Molares dos metais: Ag = 107,8 – Au = 197 – Cu = 63,5 – Zn = 65,4
Questão 27. (D) – Prova Comentada UFRGS 2017
Comparando o gráfico com a tabela, temos que, à 60 graus a solubilidade do KNO3 é menor do que a do NaNO3, e a 75 graus inverte
Questão 28. (B) – Prova Comentada UFRGS 2017
1) Tendência a perder 2 elétrons é uma característica dos metais com com 2 elétrons na camada de valência. Nesse caso estamos falando dos metais alcalinos terrosos (grupo 2):
Encontramos nas alternativas o Ba e o Ca.
Sendo A = Z + N
O 56Ba137 N= 137 – 56 = 81 nêutrons
20Ca40 N = 40 – 20 = 20 neutrons
Questão 29. (C) – Prova Comentada UFRGS 2017
A massa atômica é calculada pela média ponderal das massas de todos os isótopos de e um elemento. A diferença entre um isótopo e outro é somente no número de nêutrons.
Questão 30. (A) – Prova Comentada UFRGS 2017
O raio atômico cresce de acordo com as setas indicadas no gráfico. Localizando os elementos na tabela temos que a ordem crescente de raio é: Ga < Cr < K < Cs.
Questão 31. (D) – Prova Comentada UFRGS 2017
I (F) – O CCl4 é apolar, de geometria tetraédrica.
II (V) – O Hexano e o CCl4 por serem apolares se misturam entre si formando apenas uma fase, quando colocados na ordem certa. “Semelhante dissolve semelhante”
III (V) – Sabendo-se que o Hexano tem menor densidade, então em iguais volumes a massa de dessa substância será menor do que da água, pois d=m/v
Questão 32. (A) – Prova Comentada UFRGS 2017
Sendo o número de prótons (Z) igual ao número de elétrons e somando-se o número de elétrons de cada átomo X, Y e Z temos respectivamente:
X=11 elétrons (metal Na)
Y=17 elétrons (Ametal Cl)
Z=10 elétrons (Gás nobre Ne)
Metal se liga a Ametal por ligação iônica
Questão 33. (D) – Prova Comentada UFRGS 2017
Precisamos calcular a razão entre o número de Hidrogênio e a massa molecular de cada estrutura
A- C4H8 = 8/56 = 1/7
B- C4H10 = 10/58 = 1/5,8
C- não é um hidrocarboneto.
D- C5H12 = 12/72 = 1/6
E- C6H6 = 6/78 = 1/13
Questão 34. () – Prova Comentada UFRGS 2017
Como as massas dos reagentes são iguais a 10g o reagente limitante será aquele de maior massa molecular. sendo assim não há necessidade de descobrir quem está em excesso e quem é o limitante.
O NH3 está em excesso e o reagente limitante é o NH2Cl.
NH2Cl + NH3 → N2H4 + HCl
51,5 g …………………….. 32 g
10 g ………………………. x = 6,21 g
Questão 35. (C) – Prova Comentada UFRGS 2017
NaN3 → 3/2 N2 + 1 Na Multiplicando a equação por 2 para obtenção de números inteiros temos:
2 NaN3(s) → 3 N2+ 2Na Somando os coeficientes inteiros temos: 2 + 3 + 2 = 7
Questão 36. (A) – Prova Comentada UFRGS 2017
H2+1S+6O4-2 K+1H-1 H20 H2+1O2-1 Na+1H+1CO3-2
O número de oxidação do Hidrogênio em cada estrutura é: +1,-1,0,+1,+1
Questão 37. (E) – Prova Comentada UFRGS 2017
H2SO4 ácido sulfúrico – ácido de bateria de automóveis atualmente em desuso.
Mg(OH)2 base fraca – antiácido estomacal
H3PO4 ácido fosfórico – usado em refrigerantes para dar o sabor adocicado na proporção de 1g/L.
HClO ácido hipocloroso – Usado em produtos de limpeza como alvejante.
Questão 38. (A) Resolução da Prova de Química UFRGS 2017
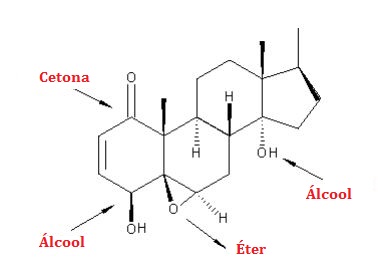
I (V) Como a estrutura só tem Hidrogênio e Carbono ela é um é um hidrocarboneto.A cadeia é alifática pois não é aromática e é insaturada pois possui uma ligação dupla.
II (F). A geosmina não possui heteroátomos entre carbonos.
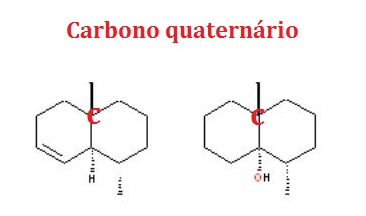
III (F) As estruturas apresentam apenas um carbono quaternário, ou seja, carbono ligado a mais 4 átomos de carbonos.
Questão 39. (E) Resolução da Prova de Química UFRGS 2017
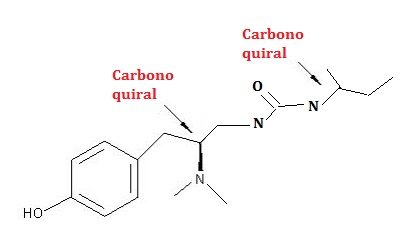
O número de esterioisomeros é igual ao número de isômeros opticamente ativos.
Será calculado por: 2n, onde o n é o número de carbonos assimétricos, logo, 2n = 22 = 4.
Questão 40. (C) Resolução da Prova de Química UFRGS 2017
Questão 41. () Resolução da Prova de Química UFRGS 2017
1) Na Metionina temos uma cadeia de um aminoácido facilmente identificável
2) Para resolver essa questão o aluno deveria conhecer a classificação abaixo:
2 aminoácidos ligados = dipeptídio
70 aminoácidos ligados = polipeptídeo
80 aminoácidos ligados = proteína
Logo no Met-Met temos um dipeptídeo e não uma proteína
Questão 42. (B) Resolução da Prova de Química UFRGS 2017
Reações extérmicas com variação de entalpia negativa, liberam calor e são normalmentede de formação
Reações endotérmicas com variação de entalpia positiva, absorvem calor e normalmentede rompem suas ligações intermoleculares.
I (F) Vaporização é um processo endotérmico. Exemplo Rompe-se as Pontes de Hidrogênio na água
II (V) Reações de combustão são exotérmicas. Exemplo formação de CO2
III (F) A reação da cal viva + água libera calor, logo será exotérmica.
Questão 43. (B) Resolução da Prova de Química UFRGS 2017
Primeiramente temos, no composto “C” uma substituição do Br pelo radical CH3O- e também, pelo aparecimento da liga dupla temos no composto “D” uma eliminação
Questão 44. (C) Resolução da Prova de Química UFRGS 2017
Essa questão apresentou uma novidade para os vestibulandos. Apareceu a isomeria geométrica em compostos com dupla na ligação entre nitrogênios e não entre carbonos como o habitual.
I (V) Composto = trans e o composto B = cis.
II (V) O Nitrogênio da estrutura NH3 forma pontes de Hidrogênio ou ligações de hidrogênio com o heterociclo
III (F) Os nitrogênio da ligação –N=N- apresentam geometria linear
Questão 45. (D) Resolução da Prova de Química UFRGS 2017
I (V) No gráfico da direita temos uma solução, por ter o ponto de congelamento variável
II (F) A mistura sempre apresentará ponto de congelamento menor do que o do solvente puro.
III (V) As soluções tem ponto de congelamento menor do que o do seu solvente puro.
Questão 46. (D) Resolução da Prova de Química UFRGS 2017
Vamos inicialmente calcular a constante de equilíbrio para a equação dada:
V = k x [A]2 . [B]
k = v / [A]2 . [B] → k = 3,0 . 10-5 / [10-2] 2 . 10-2 → k = 30
Agora vamos encontrar as velocidades x e y
x = k . [A]2 . [B] → x = 30 . [2 . 10-2] 2 . [10-2]
x = 12 . 10-5
y = k x [A]2 . [B] → y = 30 . [2 . 10-2] 2 . [2 x 10-2]
y = 24 x 10-5.
Questão 47. (E) Resolução da Prova de Química UFRGS 2017
I (V) Reações endotérmicas, com aumento de temperatura, desloca o equilíbrio para direita, a favor dos produtos.
II (V) Aumentando-se a pressão haverá deslocamento no sentido de menor volume. Os reagentes
III (V) Quanto maior a temperatura, maior será a velocidade da reação. Isso acontece porque, com o aumento da temperatura, a energia cinética das moléculas das substâncias aumenta, ou seja, elas movimentam-se em uma maior velocidade, o que aumenta a quantidade de choques efetivos que resultam em uma reação mais rápida.
Questão 48. (B) Resolução da Prova de Química UFRGS 20177
I (F) O valor da constante Ka = 6,6.10-4 é muito baixo sendo o HF um ácido fraco.
II (V) Ka = [produtos] / [reagentes]. Para o HF temos: Ka = [H+].[F–] / [[HF]
quanto maior o grau de ionização, maior o Ka e mais forte será o ácido.
III (F) O fluoreto de sódio tem o cátion sódio, pertencente ao grupo I da tabela isso é o suficiente para ele ser solúvel.
Questão 49. (C) Resolução da Prova de Química UFRGS 20177
Quanto maior for a concentração de íons [H+], mais forte será o ácido e menor será o pH.
Quanto maior a concentração de íons maior será a constante Ka.
Logo quanto maior o Ka menor o pH
HCOOH < CH3COOH < HCN.
Questão 50. (E) Resolução da Prova de Química UFRGS 20177
I (V) O lítio metálico apresenta menor potencial de redução, logo irá se oxidar com maior facilidade. Ele também será o melhor agente redutor.
II (V) A preta tem maior potencial de redução do que o cobre, logo ela se reduz e o cobre se oxida.
III (V) O ânodo é sempre aquele que apresenta o menor potencial de redução. Como o Zinco tem potenciais de redução (-0,76V) e o chumbo (-0,13V), o Zinco será o ânodo da pilha.