Enem 2017 Resolução da Prova de Química

Prova Comentada! Veja aqui tudo sobre o Enem 2017 Resolução da Prova de Química
Questão 91 –Enem 2017 Prova Amarela
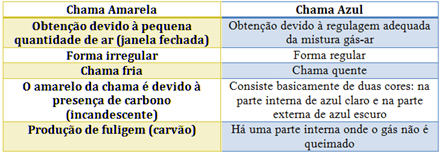
Um fato corriqueiro ao se cozinhar arroz é o derramamento de parte da água de cozimento sobre a chama azul do fogo, mudando-a para uma chama amarela. Essa mudança de cor pode suscitar interpretações diversas, relacionadas às substâncias presentes na água de cozimento. Além do sal de cozinha (NaCl), nela se encontram carboidratos, proteínas e sais minerais. Cientificamente, sabe-se que essa mudança de cor da chama ocorre pela
a) reação do gás de cozinha com o sal, volatilizando gás cloro.
b) emissão de fótons pelo sódio, excitado por causa da chama.
c) produção de derivado amarelo, pela reação com o carboidrato.
d) reação do gás de cozinha com a água, formando gás hidrogênio.
e) excitação das moléculas de proteínas, com formação de luz amarela.
Resolução:
Situação 1 – Ao cair a água contaminada com o sal de cozinha temos a queima do NaCl. Os elétrons do Sódio, presentes no Cloreto de Sódio ao receber a energia do fogo geram saltos quânticos que é mostrado pela cor amarela da chama. Por isso a resposta é letra B

Situação 2 – Ao cair água no fogo a quantidade de oxigênio é diminuída, alterando a combustão. Essa perda de Oxigênio da combustão altera a cor da chama. Veja na figura abaixo as cores da chama do gás de cozinha (Propano e Butano) quando reagem com quantidades diferentes de O2.
Quantidade de oxigênio
- As cores vão de amarelo (pouco Oxigênio e combustão incompleta), até um azul (muito Oxigênio e combustão completa).
Quando a combustão é incompleta temos uma temperatura da chama menor que fica em torno de 1500 K e nessa temperatura os saltos eletrônicos são menores, originando no 0 seu retorno energias menores. Dessa forma uma cor amarelada determina que temos menos energia do que na chama azul que pode atingir até 2300 k.
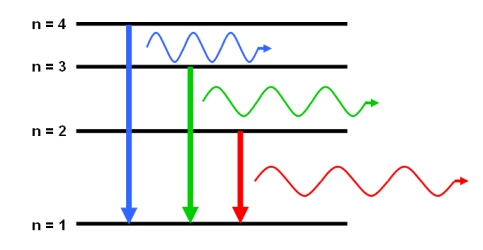
Sabemos que a cor do espectro é determinado pelo retorno do elétron ao nível de origem. Quanto maior a energia recebida, mais longe esse elétron vai e obviamente maior será o seu salto de retorno. É nesse momento que a energia é devolvida e dessa forma temos a formação correspondente ao tamanho do salto eletrônico.
Veja aqui no desenho abaixo a radiação no espectro visível: Quando o elétron retorna do nível 4 para o 1 libera a energia que corresponde ao azul.
Os Hidrocarbonetos não reagem com NaCl contido na água e por isso a alternativa A está descartada
O gás hidrogênio é muito reativo e reagiria fortemente com o fogo, descartando a alternativa D
Pela análise das duas situações possíveis, nas alternativas, verificamos que está presente somente a situação 1, logo a resposta é:
Resposta – Letra B
Curso Online de Matemática para o Enem e Vestibular com muitos bônus!
Enem 2017 Resolução da Prova de Química
Questão 95 – Enem 2017 Prova Amarela
A farinha de linhaça dourada é um produto natural que oferece grandes benefícios para o nosso organismo. A maior parte dos nutrientes da linhaça encontra-se no óleo desta semente, rico em substâncias lipossolúveis com massas moleculares elevadas. A farinha também a presenta altos teores de fibras proteicas insolúveis em água, celulose, vitaminas lipossolúveis e sais minerais hidrossolúveis.
Considere o esquema, que resume um processo de separação dos componentes principais da farinha de linhaça dourada.
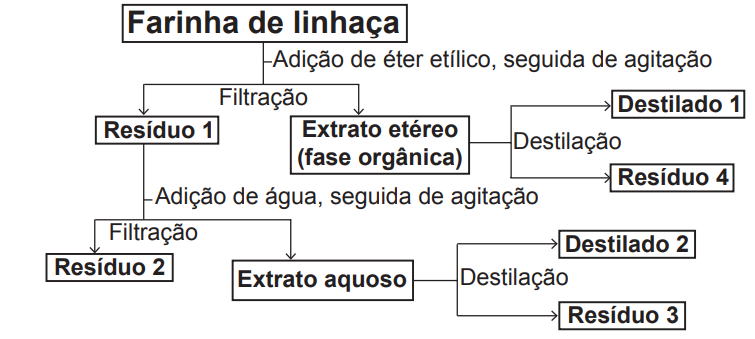
O óleo de linhaça será obtido na fração
a) Destilado 1.
b) Destilado 2.
c) Resíduo 2.
d) Resíduo 3.
e) Resíduo 4.
Resolução:
O óleo pertence a função Ester derivado de ácido graxo que apresenta uma cadeia apolar e parte polar.
Pela regra da solubilidade: “semelhante dissolve semelhante”, logo ele formara fase única em substâncias apolares (extrato etéreo).
O Éster, por ser derivado de ácidos graxos, têm a maior parte da cadeia apolar e uma parte polar.
Na etapa inicial o solvente polar é adicionado e o óleo de linhaça é dissolvido, indo para o extrato da fase orgânica. Após a destilação sobra o resíduo 4 por ter massa molar maior.
Resolução da prova de química Enem 2017
Resposta – Letra E
Enem 2017 Resolução da Prova de Química
Questão 96 – Enem 2017 Prova Amarela
O biodiesel é um biocombustível obtido a partir de fontes renováveis, que surgiu como alternativa ao uso do diesel de petróleo para motores de combustão interna. Ele pode ser obtido pela reação entre triglicerídeos, presentes em óleos vegetais e gorduras animais, entre outros, e álcoois de baixa massa molar, como o metanol ou etanol, na presença de um catalisador, de acordo com a equação química:

A função química presente no produto que representa o biodiesel é
a) éter.
b) éster.
c) álcool.
d) cetona.
e) ácido carboxílico
Os produtos são o propanotriol e o biodiesel que por apresentar a estrutura R-COO-R` pertence a função orgânica éster.
Resposta – Letra B
Enem 2017 Resolução da Prova de Química
Questão 100 – Enem 2017 Prova Amarela
Partículas microscópicas existentes na atmosfera funcionam como núcleos de condensação de vapor de água que, sob condições adequadas de temperatura e pressão, propiciam a formação das nuvens e consequentemente das chuvas. No ar atmosférico, tais partículas são formadas pela reação de ácidos (HX) com a base NH3 , de forma natural ou antropogênica, dando origem a sais de Amônio NH4X, de acordo com a equação química genérica:
HX (g) + NH3(g) → NH4 X (s)
FELIX, E. P.; CARDOSO,
A. A. Química Nova (adaptado)
A fixação de moléculas de água pelos núcleos de condensação ocorre por
a) ligações iônicas
b) interações dipolo-dipolo.
c) interações dipolo-dipolo induzido.
d) interações íon-dipolo.
e) ligações covalentes.
Resolução
O Haleto de Amônio apresenta os íons: NH4+ e X–
Ao entrar em contato com a água são separados da seguinte maneira:
O cátion NH4+ é rodeado pelos ânions OH– da água e o ânion X– é rodeado pelos cátions H+ da água.
Então temos aqui as interações íon (sal) e dipolo (água) = íon-dipolo.
Resposta – Letra D
Enem 2017 Resolução da Prova de Química
Questão 102 – Enem 2017 Prova Amarela
A técnica do carbono-14 permite a datação de fósseis pela medição dos valores de emissão beta desse isótopo presente no fóssil. Para um ser em vida, o máximo são 15 emissões beta/(min g). Após a morte, a quantidade de C 14 se reduz a metade a cada 5730 anos.
Considere que um fragmento fóssil de massa igual a 30 g foi encontrado em um sítio arqueológico, e a medição de radiação apresentou 6750 emissões beta por hora. A idade desse fóssil, em anos, é
a) 450
b) 1433
c) 11460
d) 17190
e) 27000
Resolução
Em 1 min temos em 1 g 15 emissões Beta. Em 1 h (60 min) temos 15 x 60 = 900 emissões beta/hora
1 g ———— 900 emissões beta/hora
30 g ———— x
logo houve no início 27000 emissões
27000 emissões (1/2 vida) ———- 13500 emissões (1/2 vida) ———- 6750 emissões
logo temos duas meias vidas = 2 x 5730 anos 11.460 anos
Resposta – Letra C
Questão 104 – Enem 2017 Prova Amarela
A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir de uma solução aquosa de cloreto de sódio. Nesse procedimento, utiliza-se uma célula eletroquímica, como ilustrado.
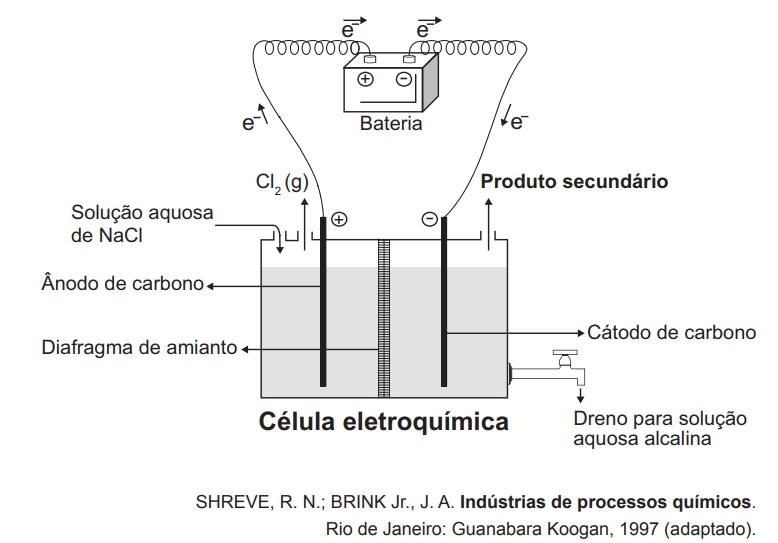
No processo eletrolítico ilustrado, o produto secundário obtido é o
a) vapor de água.
b) oxigênio molecular.
c) hipoclorito de sódio.
d) hidrogênio molecular.
e) cloreto de hidrogênio.
Resolução
Entre o Na+ e o H3O+, o Na+ é um metal alcalino, sendo mais reativo. Por isso, a os íons H+ recebe os elétrons do cátodo:
Semi-reação no cátodo: 2 H+ + 2e– → H2
Agora, no caso dos ânions, o Cl– é menos reativo que o OH– e, por isso, sofre oxidação:
Semi-reação no ânodo: 2 Cl– → Cl2 + 2e–
Resposta – Letra D
Enem 2017 Resolução da Prova de Química
Questão 106 – Enem 2017 Prova Amarela
A toxicidade de algumas substâncias é normalmente representada por um índice conhecido DL50 (dose letal mediana). Ele representa a dosagem aplicada a uma população de seres vivos que mata 50% desses indivíduos e é normalmente medido utilizando ratos como cobaias. Esse índice é muito importante para os seres humanos, pois, ao se extrapolar os dados obtidos com o uso de cobaias, pode-se determinar o nível tolerável de contaminação de alimentos, para que possam ser consumidos de forma segura pelas pessoas. O quadro apresenta três pesticidas e suas toxicidades. A unidade mg/kg Indica a massa da substância ingerida pela cobaia.
| Pesticidas | DL50 (mg/kg) |
| Diazinon | 70 |
| Malation | 1000 |
| Atrazina | 3100 |
Sessenta ratos. Com massa de 200 g cada, foram divididos em três grupos de vinte. Três amostras de ração, contaminadas, cada uma delas com um dos pesticidas indicados no quadro, na concentração de 3 mg por grama de ração, foram administradas para cada grupo de cobaias. Cada rato consumiu 100 g de ração.
Qual(ais) grupo(s) terá(ão) uma mortalidade mínima de 10 ratos?
a) O grupo que se contaminou somente com atrazina.
b) O grupo que se contaminou somente com diazinon
c) Os grupos que se contaminaram com atrazina e malation.
d) Os grupos que se contaminaram com diazinon e malation
e) Nenhum dos grupos contaminados com atrazina, diazinon e malation.
Resolução
- total = 60 ratos divididos em 3 grupos de 20 ratos
- 3 mg tóxico/g de ração
- Cada rato tem massa 200 g e consumiu 100 g
Cálculo da massa de pesticida consumida por rato:
1 g de ração ———– 3 mg de pesticida
100 g de ração ——- X X = 300 mg de pesticida
DL50 —informa a quantidade de pesticida em mg por kg da cobaia (unidade mg/kg)
Dividindo a quantidade de pesticida ingerida (300 mg) pela massa do rato e comparando com a DL50
Obs: rato tem 200 g = 0,2 kg
300 mg / 0,2 kg = 1500 mg/kg
| Pesticidas | DL50 (mg/kg) |
| Diazinon | 70 |
| Malation | 1000 |
| Atrazina | 3100 |
Comparando com a tabela dada temos que : Os grupos se contaminaram com diazinon e malation
Resposta – Letra D
Enem 2017 Prova comentada de Química
Questão 114 – Enem 2017 Prova Amarela
O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol) é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:
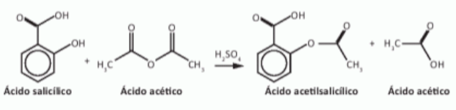
Após a síntese, o AAS é purificado e o rendimento final é de aproximadamente 50%. Devido às propriedades farmacológicas (antitérmico, analgésico e anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento nas formas de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
a) 293
b) 345
c) 414
d) 690
e) 828
Resolução
Cada comprimido tem 500 mg = 0,5 g
900 mil comprimidos: 900.000 x 0,5 =450.000 g = 450 kg

138 g ————————————————– 180 g
X ————————————————— 450 kg
X = 450 x 138 / 180
X = 345 g
Rendimento = 50%: 1 mol de AS produz 0,5 mol de AAS.
345 g —————- 50%
x ————— 100%
X = 690 g
Resposta – Letra D
Enem 2017 Resolução da Prova de Química
Questão 116 – Enem 2017 Prova Amarela
O ferro é encontrado na natureza na forma de seus minérios, tais como a hematita (α-Fe2O3), a magnetita (Fe3O4) e a wustita (FeO). Na siderurgia, o ferro gusa é obtido pela fusão de minérios de ferro em altos fornos em condições adequadas. Uma das etapas nesse processo é a formação de monóxido de carbono. O CO (gasoso) é utilizado para reduzir o FeO (sólido), conforme a equação química:
FeO (s) + CO (g) –> Fe (s) + CO2 (g)
Considere as seguintes equações termoquímicas:
Fe2O3 (s) + 3 CO (g) –> 2 Fe (s) + 3 CO2 (g) ∆H = –25 kJ/mol de Fe2O3
3 FeO (s) + CO2 (g) –> Fe3O4 (s) + CO (g) ∆H = –36 kJ/mol de CO2
2 Fe3O4 (s) + CO2 (g) –> 3 Fe2O3 (s) + CO (g) ∆H = +47 kJ/mol de CO2
O valor mais próximo de ∆rH em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é
a) -14
b) -17
c) -50
d) -64
e) -100














Resolução
Fe2O3 (s) + 3 CO (g) –> 2 Fe (s) + 3 CO2 (g) ∆H = –25 kJ/mol de Fe2O3
3 FeO (s) + CO2 (g) –> Fe3O4 (s) + CO (g) ∆H = –36 kJ/mol de CO2
2 Fe3O4 (s) + CO2 (g) –> 3 Fe2O3 (s) + CO (g) ∆H = +47 kJ/mol de CO2
FeO (s) + CO (g) –> Fe (s) + CO2 (g)
Usando a Lei de Hess :
1/2 Fe2O3 (s) + 3/2 CO (g) –> Fe (s) + 3/2 CO2 (g) ∆H = –25 / 2
FeO (s) + 1/3CO2 (g) –> 1/3Fe3O4 (s) + 1/3 CO (g) ∆H = –36 / 3
1/3 Fe3O4 (s) + 1/6CO2 (g) –> 1/2 Fe2O3 (s) + 1/6 CO (g) ∆H = +47 / 6
————————————————————-
Equação global: FeO + CO → Fe + CO2
⧍H = (-25)/2 + (-36/3) + 47/6 = -17 kJ/mol
Resposta – Letra B
Enem 2017 Resolução da Prova de Química
Questão 117 – Enem 2017 Prova Amarela
A invenção do LED azul, que permite a geração de outras cores para compor a luz branca, permitiu a construção de lâmpadas energeticamente mais eficientes e mais duráveis do que as incandescentes e fluorescentes. Em um experimento de laboratório, pretende-se associar duas pilhas em série para acender um LED azul que requer 3,6 volts para o seu funcionamento. Considere as semi-reações de redução e seus respectivos potenciais mostrados no quadro.
Qual associação em série de pilhas fornece diferença de potencial, nas condições-padrão, suficiente para acender o LED azul?
Resolução
A pilha que produz maior potencial
2Ce+4 + 2 e → 2Ce+3 Eredução = +1,61 V
Zn0 – 2 e → Zn+2 Eoxidação = +0,76 V
————————————————–
2Ce+4 + Zn0 → 2Ce+3 + Zn+2 Eglobal 1 = 2,37 V
Cr2O7 -2 + 14 H+ + 6 é → 2 Cr+3 + 7 H2O Eredução = +1,33 V
3Ni – 6 → 3Ni+2 Eoxidação = +0,25 V)
————————————————-
Cr2O7 -2 + 14 H+ + 3 Ni → 2 Cr+3 + 3Ni+2 + 7 H2O Eglobal 2 = +1,58 V
Etotal = Eglobal 1 + Eglobal 2 = 2,37 v + 2,58 v = 3,95 V
Como o Etotal das duas pilhas somadas é maior que 3,6 V o LED azul se acenderá!
Resposta – Letra C
Questão 120 – Enem 2017 Prova Amarela
COSTA, P. R. R. et al. Ácidos e bases em química orgânica Porto Alegre: Bookman, 2005 (adaptado).
Oual solução deve ser usada para extração do lapacho da serragem do ipê com maior eficiência?
a) Solução de Na2CO3 para formar um sal de lapachol.
b) Solução-tampão ácido acético/acetato de sódio (pH = 4,5).
c) Solução de NaCl a fim de aumentar a força iônica do meio.
d) Solução de Na2SO4 para formar um par iônico com lapachol.
e) Solução de HCl a fim de extraí-lo por meio de reação ácido-base.
Resposta: A
Dados: pK = -log K
O valor pK = 6 indica que temos um Ph ácido. Para extrair esse composto a solução indicada deverá ter um caráter básico, dessa forma haverá reação e solubilização.
A melhor alternativa é com Na2CO3
Esse sal tem origem da reação do NaOH (Base forte) com H2CO3 (ácido moderado). Dessa forma o Na2CO3 será um sal básico.
Resposta – Letra A
Questão 121 – Enem 2017 Prova Amarela
Alguns tipos de dessalinizadores usam o processo de osmose reversa para obtenção de água potável a partir da água salgada. Nesse método, utiliza-se um recipiente contendo dois compartimentos separados por uma membrana semipermeável: em um deles coloca-se água salgada e no outro recolhe-se a água potável. A aplicação de pressão mecânica no sistema faz a água fluir de um compartimento para o outro. O movimento das moléculas de água através da membrana é controlado pela pressão osmótica e pela pressão mecânica aplicada. Para que ocorra esse processo é necessário que as resultantes das pressões osmótica e mecânica apresentem
a) mesmo sentido e mesma intensidade.
b) sentidos opostos e mesma intensidade.
c) sentidos opostos e maior intensidade da pressão osmótica.
d) mesmo sentido e maior intensidade da pressão osmótica.
e) sentidos opostos e maior intensidade da pressão mecânica.
Resolução
Osmose é a passagem de água de um meio menos concentrado (hipotônico) para outro mais concentrado (hipertônico), através de uma membrana semipermeável. Ela não é influenciada pela natureza do soluto, mas pelo número de partículas.
Quando se comparam soluções de concentrações diferentes, a que possui mais soluto e, portanto, maior pressão osmótica é chamada hipertônica, e a de menor concentração de soluto e menor pressão osmótica é hipotônica. Separadas por uma membrana, há maior fluxo de água da solução hipotônica para a hipertônica, até que as duas soluções se tornem isotônicas.
Resolução da Prova de Química
Resposta – Letra E
Questão 128 – Enem 2017 Prova Amarela
A ozonólise, reação utilizada na indústria madeireira para a produção de papel, é também utilizada em escala de laboratório na síntese de aldeídos e cetonas. As duplas ligações dos alcenos são clivadas pela oxidação com o Ozônio (O), em presença de água e zinco metálico, e a reação produz aldeídos e/ou cetonas, dependendo do grau de substituição da ligação dupla. Ligações duplas dissubstituídas geram cetonas, enquanto as ligações duplas terminais ou monossubstituídas dão origem a aldeídos. Como mostra o esquema.
Considere a ozonólise do composto 1-fenil-2-metilprop-1-eno:
MARTINO, A, Química, a ciência global, Goiânia: Editora W, 2014 (adaptado),
Ouais são os produtos formados nessa reação?
a) Benzaldeido e propanona.
b) Propanal e benzaldeido.
c) 2-fenil-etanale metanal.
d) Benzeno e propanona.
e) Benzaldeído e etanal.
Resolução
Conforme o texto, as ligas duplas de alcenos são oxidadas pelo Ozônio, em presença de água e zinco metálico, e a reação produz aldeídos e/ou cetonas, dependendo do grau de substituição da ligação dupla. Ligações duplas dissubstituídas geram cetonas, enquanto as ligações duplas terminais ou monossubstituídas dão origem a aldeídos.
No círculo vermelho temos uma dupla terminal gerando o Benzaldeido
No círculo azul temos ligas duplas dissubstituidas gerando a propanona
Resposta – Letra A
Questão 131 – Enem 2017 Prova Amarela
A cromatografia em papel é um método de separação que se baseia na migração diferencial dos componentes de uma mistura entre duas fases imiscíveis. Os componentes da amostra são separados entre a fase estacionária e a fase móvel em movimento no papel. A fase estacionária consiste de celulose praticamente pura, que pode absorver até 22% de água. É a água absorvida que funciona como fase estacionária líquida e que interage com a fase móvel, também líquida (partição líquido-líquido). Os componentes capazes de formar interações intermoleculares mais fortes com a fase estacionária migram mais lentamente.
Uma mistura de hexano com 5% (v/v) de acetona foi utilizada como fase móvel na separação dos componentes de um extrato vegetal obtido a partir de pimentões. Considere que esse extrato contém as substâncias representadas.
RIBEIRO, N.M.; NUNES, C. R. Análise de pigmentos de pimentões por cromatografia em papel, Química Nova na Escola, n.29, ago. 2008 (adaptado).
A substância presente na mistura que migra mais lentamente é o(a)
a) licopeno.
b) α-caroteno.
c) γ-caroteno.
d) capsorubina.
e) α-criptoxantina.
Resolução
A substancia que interagem mais com a fase estacionária são as que migram lentamente Celulose é uma estrutura polar. Para interagir com a celulose a substância deve ter mais grupamentos polares.
Observe nas alternativas D e E apresentam grupos polares, porém a capsorubina é a que interage mais e a que migra mais lentamente
Resposta – Letra D